Istraživači iz Kine i Velike Britanije otkrili su bakterije iz creva u oštećenim delovima očiju miševa sa mutacijama proteina krambs homolog (crumbs homolog) koji je kod ljudi kodiran u (CRB1) genu, i koji je glavni uzrok naslednih bolesti očiju.
“Pronašli smo neočekivanu vezu između creva i oka, što bi moglo da rasvetli uzrok slepila kod nekih pacijenata”, kaže oftalmolog Ričard Li sa Univerzitetskog koledža u Londonu, viši autor studije.
“Naši nalazi mogli bi imati ogromne implikacije za transformaciju lečenja očnih bolesti povezanih sa CRB1”, dodaje Li.
U pitanju je rano istraživanje i ne zna se da li se isti mehanizam dešava kod ljudi sa mutacijom tog gena, koja uzrokuje četiri procenta pigmentnog retinitisa, što dovodi do gubitka perifernog i noćnog vida, i 10 procenata Leberove kongenitalne amauroze, gde dolazi do potpunog slepila u oko trećini slučajeva.
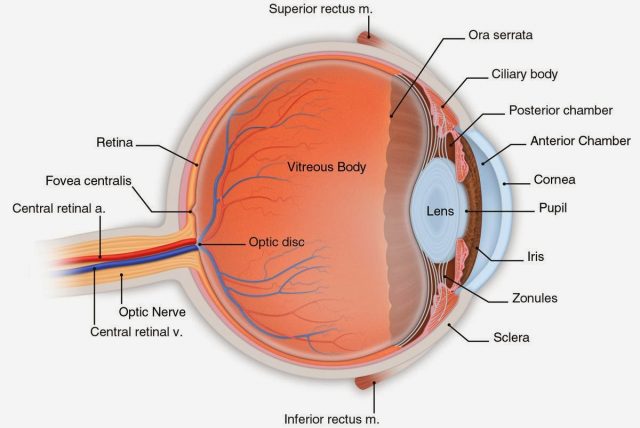
Kod očnih bolesti povezanih sa CRB1, oštećenje vida počinje rano. Retina – tkivo u zadnjem delu naših očiju koje pretvara talasne dužine svetlosti u signale, i koje naš mozak tumači kao vid, ne uspeva da razvije svoju tanku slojevitu strukturu fotoreceptorskih ćelija osetljivih na svetlost, postajući abnormalno debela.
Većina od biliona crevnih bakterija koje imamo su korisne, a ne štetne, i igraju ključnu ulogu u ukupnom zdravlju. Ali Li i njegove kolege misle da mutacija CRB1 dozvoljava bakterijama creva da dođu do očiju, gde mogu doprineti gubitku vida.
Smatralo se da se navedeni protein nalazi samo u mozgu i pigmentnom epitelu mrežnjače (RPE) – spoljašnjoj barijeri krvi i retine koja štiti oko. Po prvi put istraživači su otkrili da crevni zid takođe ima protein koji se kodira genom, odgovornim, između ostalog, za vid.
CRB1 protein je od vitalnog značaja za održavanje barijere između creva i ostatka tela i RPE. Mutirani gen inhibira (usporava) dejstvo tog proteina, što dovodi do razbijanja dve zaštitne barijere.
Mišji modeli mutacije su imali oštećenja u obe ove barijere, omogućavajući crevnim bakterijama da prođu kroz krvotok u mrežnjaču i izazovu lezije (povrede). Lečenje antibioticima smanjilo je oštećenje mrežnjače i sprečilo gubitak vida.
Kada su istraživači ponovo uveli normalnu ekspresiju proteina kod miševa sa mutiranim genima, to nije poništilo proboj barijere, ali je oštećenje mrežnjače smanjeno. I miševi sa mutiranim CRB1 sa smanjenom populacijom bakterija, takođe nisu pokazali velika oštećenja mrežnjače.
“Nadamo se da ćemo nastaviti ovo istraživanje u kliničkim studijama kako bismo potvrdili da li je ovaj mehanizam zaista uzrok slepila kod ljudi i da li tretmani koji ciljaju bakterije mogu sprečiti slepilo”, kaže Li.
Pronađena korelacija samo ukazuje na moguću vezu između očnih bolesti uzrokovanih mutacijom gena CRB1. Skoro 100 gena koji utiču na fotoreceptorske ćelije mrežnjače osetljive na svetlost mogu izazvati pigmentozni retinitis, a varijante u najmanje 28 gena mogu izazvati Leberovu kongenitalnu amaurozu.
Genska terapija je pokazala obećavajuće rezultate u lečenju genetički uslovljenih očnih bolesti i do sada je bila glavni fokus u razvoju vrste lekova i tretmana.
Autori kažu da njihovi nalazi pokazuju da su creva i oči povezani na drugi način. Žive bakterije mogu da se kreću iz creva koja ih propuštaju čak do mrežnjače. Još uvek ne razumemo u potpunosti vezu creva sa zdravljem očiju, ali bi to mogao biti još jedan put lečenja koji treba razmotriti.
“Pošto smo otkrili potpuno novi mehanizam koji povezuje degeneraciju mrežnjače sa crevima, naši nalazi mogu imati implikacije na širi spektar očnih stanja, za koje se nadamo da ćemo nastaviti da istražujemo sa daljim studijama”, zaključuje Li.
Istraživanje je objavljeno u časopisu “Cell”. (Izvor:RTS)






0 Comments